골격단백질의 구조 안정화를 통한 퇴행성 질환 치료 가능성 제시
건국대학교 KU융합과학기술원 김동은 교수(융합생명공학과) 연구팀이 퇴행성 질환의 주된 원인 중 하나인 손상된 미토콘드리아의 세포 내 누적 억제와 미토콘드리아 회복 기전을 밝혀냈다.

이번 연구는 과학기술정보통신부에서 시행한 과학기술분야 기초연구사업의 중견연구자지원-전략과제(과제명: 산화스트레스로부터 미토콘드리아 항상성 유지를 위한 중간섬유단백질 케라틴의 역할 연구)의 지원으로 이루어졌으며, 김동은 교수(사진 왼쪽), 백아름 박사(사진 가운데)와 손수민(사진 오른쪽, 박사과정) 학생이 참여했다.
최근 미토콘드리아의 기능 장애가 알츠하이머 병, 파킨슨 병 및 황반변성 등 여러 퇴행성 질환의 주된 원인으로 밝혀지면서, 손상된 미토콘드리아의 회복 또는 미토콘드리아 항상성 유지 기전을 규명하는 것이 매우 중요해졌다.
연구팀은 세포골격단백질의 구조를 안정시킴으로써 산화스트레스에 의해 손상된 미토콘드리아가 제거되고, 건강한 미토콘드리아가 생성되는 항상성(homeostasis) 유지 기전을 통해 세포를 보호할 수 있다는 것을 확인했다. 스트레스에 의해 미토콘드리아가 손상되면, 손상된 부위를 끊어내는 분열이 일어난다. 분열된 미토콘드리아는 자가포식(autophagy) 대사작용을 통해 분해 및 제거되는데, 이러한 미토콘드리아의 분열에는 세포골격단백질이 관여한다. 그러나 산화스트레스는 세포골격 단백질인 중간섬유단백질의 구조를 변화시키고, 손상된 미토콘드리아가 원활하게 분열되지 못하고 커다랗게 부풀어진 형태를 띤 채 세포 내에 축적되어 사멸에 이른다는 것을 규명했다 (아래 그림).
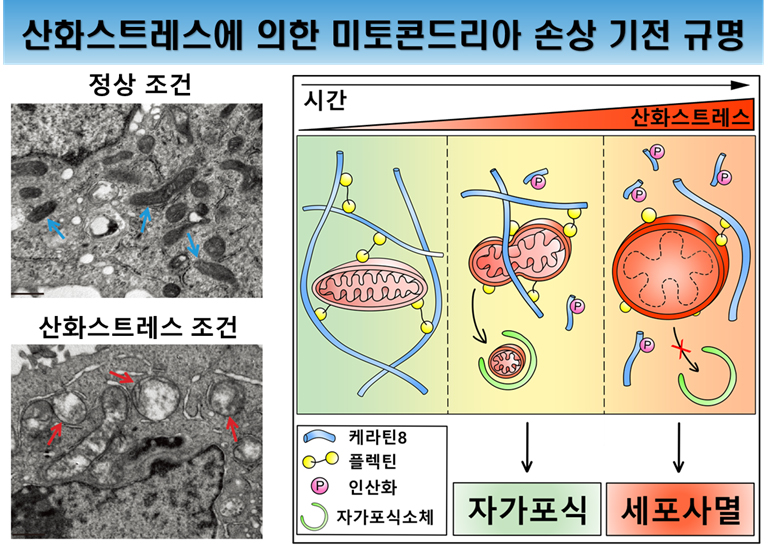
산화스트레스에 의한 미토콘드리아 손상 기전 규명
망막상피세포의 미토콘드리아의 형태 변화를 전자현미경으로 관찰한 결과, 정상 조건에서 내부구조가 잘 유지되고 있다(파란색 화살표). 하지만, 산화스트레스에 노출된 세포의 경우 내부구조가 붕괴된 부풀어진 형태의 비정상적인 미토콘드리아(빨간색 화살표)가 관찰된다.
미토콘드리아의 비정상적인 부풀어짐과 기능저하는 황반변성 환자의 망막조직에서 관찰되는 미토콘드리아 손상과 유사하다.
세포골격단백질인 케라틴8은 세포연결단백질인 플렉틴을 매개로 미토콘드리아와 결합한다. 산화스트레스에 의해 미토콘드리아가 손상되면 미토콘드리아에 결합된 세포골격단백질에 의해 손상된 부위에 분열이 일어나고, 작게 분열된 미토콘드리아는 자가포식을 통해 분해/제거되어 항상성을 유지한다. 그러나 지속적인 스트레스는 케라틴8의 인산화를 일으켜 플렉틴과 결합력이 약해짐으로써 미토콘드리아와 상호작용하지 못하게 되며, 손상된 미토콘드리아는 분열되지 못하고 누적되어 세포 사멸을 일으키게 된다.
상피세포에서 많이 발현되는 세포골격단백질 중 하나인 케라틴8가 미토콘드리아에 직접 결합하는 것이 아니라 세포 내 섬유구조체들을 연결하는 플렉틴(plectin)단백질을 매개로 결합하는데, 연구팀은 산화스트레스에 노출된 망막색소상피세포에서 케라틴8이 인산화되면서 플렉틴과 상호작용이 약해지고 미토콘드리아와 결합하지 못하는 것을 관찰했다. 연구팀은 케라틴8의 인산화를 억제하는 약물을 이용하여 세포골격 단백질의 구조 안정화를 통한 손상된 미토콘드리아의 분열 및 제거 활성화로 미토콘드리아 항상성을 유지하는 데 성공했다.
이번 연구는 자가포식 분야 세계 최고 학술지인 오토파지(Autophagy, 2019년 영향력 지수=9.770, 5년 평균 영향지수=11.966) 저널에 2021년 3월 30일자로 온라인 게재됐다(논문명: “KRT8 (keratin 8) attenuates necrotic cell death by facilitating mitochondrial fission-mediated mitophagy through interaction with PLEC (plectin)”). 발표논문 Link: https://doi.org/10.1080/15548627.2021.1897962
이러한 연구결과는 지금까지 크게 연구되지 않았던 세포골격단백질 구조 안정화가 미토콘드리아 항상성에 관련한다는 분자기전을 제시함으로써 황반변성을 비롯한 여러 퇴행성 질환에 유용한 치료제 개발의 단서가 될 것으로 기대된다. 연구진은 “본 연구에서 발굴한 약물작용점을 표적으로 하여 퇴행성 질환 치료를 위한 신약개발이 가능하도록 하는 것이 다음 목표”라고 전했다. 이번 연구성과는 생물학연구정보센터(BRIC)의 “한국을 빛내는 사람들(한빛사)” 논문으로 소개되었다 (2021.04.01.).
또한, 김동은 교수가 중증호흡기증후군(SARS) 코로나바이러스의 핵산나선효소(helicase, SARS coronavirus nsP13)의 작용기전을 분자수준에서 규명하여 2020년 3월 저널(Scientific Reports)에 게재한 논문이 최근 “Faculty of 1,000“(현재 ”Faculty Opinions“으로 바뀜)에 추천(프랑스 파스퇴르연구소 Thomas Wollert 교수 추천)되어 실리게 되었다. (논문명: “A high ATP concentration enhances the cooperative translocation of the SARS coronavirus helicase nsP13 in the unwinding of duplex RNA”, 발표논문 Link: https://doi.org/10.1038/s41598-020-61432-1)
”Faculty of 1,000”는 전 세계에서 생명과학과 의학에 가장 영향력 있는 새로운 발견이나 연구성과를 추천하는 학술지로써, 현재 창궐하는 코로나 판데믹을 제어하는데 필요한 SARS-CoV-2 항바이러스제 개발에 김동은 교수팀의 연구성과가 단서를 제공하는 것을 인정한 것이다. 이 논문 또한 BRIC의 “한빛사” 추천논문으로 소개되었다 (2021.04.02.).
SRAS코로나바이러스 핵산나선효소 (비구조 단백질 13번, nonstructural protein 13)의 바이러스 RNA복제에 필요한 RNA핵산 풀어헤침(unwinding)의 과정 (김동은교수 발표논문, Scientific Reports 2020, 10, 4481)
